Romatolojik hastalıklarda TNF-alfa inhibitörü kullanımına bağlı enfeksiyonlar
20 yılı aşkın bir süredir otoimmün hastalıklarda başarıyla kullanılan tümör nekrozis faktör (TNF) alfa (TNF-alfa) inhibitörleri tedavi protokollerinde önemli değişikliklere yol açmıştır. Romatoid artrit ve ankilozan spondilit gibi kronik otoimmün artritli hastalar TNF-alfa inhibitörü odaklı tedavilerden önemli ölçüde yarar sağlamıştır. Bununla birlikte, söz konusu ilaçların başta tüberküloz olmak üzere ciddi enfeksiyonlara yatkınlık yarattıkları ulusal ve uluslararası kayıt çalışmaları ve meta-analizlerle de gösterilmiştir. Bu riskin ilgili uzmanlık alanlarının yanı sıra birinci basamakta da farkında olunması, riskin başarıyla yönetilmesinde kilit önem taşır. Bu bakımdan TNF-alfa inhibitörlerini kullanmış/kullanmakta olan hastaların taşıdığı olası riskin tespiti ve yönetilmesi konularında birinci basamak hekimlerinin aktif rol alması beklenir.
Tam Metin
Giriş
Tümör nekrozis faktör (TNF)-alfa inhibitörü ilaçlar 20 yılı aşkın bir süredir otoimmün hastalıklarda kullanılmaktadır.1 Bu alanda kullanımı gittikçe artan TNF-alfa inhibitörleri, özellikle kritik durumlarda tedavi protokollerinde önemli değişikliklere yol açmıştır. TNF-alfa inhibitörü odaklı tedaviler, romatoid artrit (RA), ankilozan spondilit (AS), psöriyatik artrit (PsA) ve jüvenil idiyopatik artrit (JİA) gibi kronik otoimmün hastalıklarda önemli ölçüde yarar sağlamıştır.2-5 Romatolojik hastalıklarda sağladıkları bu avantajlarının yanı sıra, başta enfeksiyonlar olmak üzere ciddi bazı advers etkilere de neden olabilmektedirler.6-8 Birinci basamak sağlık hizmetinde başlangıç tedavisinde doğrudan reçetelenme alanları sınırlı olmakla birlikte, bu ilaçların takip ve yol açabileceği sorunların önlenmesi ve tespitinde bilhassa birinci basamakta çalışan hekimlere önemli sorumluluklar düşmektedir. Bu yazıda günümüzde kullanımı giderek yaygınlaşan TNF-alfa inhibitörlerinin kısa tarihçesi, romatolojik hastalıklarda güncel tedavi şemalarındaki yerleri ve bu ilaçlara bağlı enfeksiyon eğilimi ile bunların birinci basamağa yansımaları üzerinde durulmuştur.
TNF-alfa
TNF kavramı ilk kez 1975 yılında tanımlanmıştır. Önceleri endotoksinin sağladığı düşünülen tümör nekrotize edici aktiviteye esas olarak başka bir maddenin neden olduğu belirlenmiş ve makrofajlar tarafından salındığı düşünülen bu maddeye TNF adı verilmiştir.9 1985 yılına gelindiğinde yapısal olarak farklı iki sitokin (makrofaj kaynaklı TNF ve lenfosit kaynaklı lenfotoksin) tanımlanmıştır.10 Sonrasında sırasıyla TNF-alfa ve TNF-beta adını alan bu sitokinler ile ilişkili olarak 17 farklı ligand daha tanımlanmış ve böylece toplam 19 ligand ve 29 farklı reseptörden oluşan TNF süper-ailesi kavramı doğmuştur. TNF-alfanın içinde bulunduğu bu süper-aile önemli fizyolojik işlevler üstlenir. Pro-enflamatuvar etkinlik başta olmak üzere proliferasyon, apoptoz, morfogenetik değişiklikler ve farklılaşma bu işlevler arasında sıralanabilir.11
TNF-alfanın membrana yerleşik protein (transmembran) ve çözünür sitokin olmak üzere iki formu vardır. TNF-alfa, vücutta yaygın olarak bulunan TNFR-I ve ağırlıklı olarak bağışıklık sistemi, endotel ve sinir sistemi hücrelerinde bulunan TNFR-II olmak üzere iki TNF reseptörü ile etkileşir. TNFR-I çözünür ligand ile aktifleşirken, TNFR-II genellikle membrana yerleşik form ile aktifleşir.11-13 Transmembran TNF-alfa hedef hücrelerdeki reseptörlerine bağlanarak hücreden hücreye temas şeklinde ve hücre tipine özgü bir biçimde bölgesel enflamasyonun düzenlenmesine katkıda bulunur. Transmembran TNF-alfanın farklı hücrelerdeki ekspresyonu fizyolojik veya patolojik süreçlerde rol alır.
Bağışıklık yanıtının ince ayarında yer alması ve HIV, Leishmania, Listeria monocytogenes ve Mycobacterium tuberculosis gibi çeşitli viral, parazitik ve bakteriyel enfeksiyonlara karşı konak savunmasında rol alması bunlara örnek olarak gösterilebilir.13-17 Bunlardan özellikle tüberkülozda (TB) T-hücre ile makrofaj göçü ve granülom oluşumunu başlatarak akut enfeksiyona karşı etkililik gösterir.18 Çözünür TNF-alfa ise transmembran formdan TNF-alfa dönüştürücü enzim ile proteolitik olarak ayrıldıktan sonra apoptoz ve pro-enflamatuvar hücre proliferasyonu etkilerini gösterir. Bu form, lipo-polisakkaritlere, diğer bakteriyel ürünlere ve IL-1’e yanıt olarak salınır.19 Çözünür form özellikle otoimmün hastalıklar, kardiyovasküler hastalıklar, nörolojik hastalıklar, kemik hastalıkları, kanser, metabolik hastalıklar ve akciğer hastalıkları gibi durumlardaki patolojik yanıtlara aracılık eder.11
Otoimmün hastalıkların patogenezinde TNF-alfa kritik role sahiptir. Başta TNF-alfa olmak üzere, TNF süper-ailesi/reseptörleri alt tiplerinin yer aldığı bu patolojik süreçlerdeki bozukluklara örnek olarak artrit, psöriazis, Crohn hastalığı, üveit, multipl skleroz ve sistemik lupus gibi otoimmün hastalıklar gösterilebilir.11,20-22 TNF aktivitesinin düzeyi, zamanlaması ve süresi bağışıklık fizyolojisinde önemli yere sahiptir. Bu faktörlerden herhangi birinin bozulması TNF-reseptörü aracılı aktivitelerin pro-enflamatuvar, bağışıklık aktive edici veya bağışıklık baskılayıcı olmasına bağlı olarak farklı şekillerde kendini gösteren patolojilerin ortaya çıkmasına neden olabilmektedir.22
TNF-alfa İnhibitörü ilaçlar
TNF-alfanın artmış ekspresyonuyla seyreden patolojilerde TNF-alfa blokajı iki yolla sağlanır: TNF-alfaya karşı monoklonal antikorlar veya füzyon proteinleri. Monoklonal antikorlara patolojik süreçlerde rol alan insan proteinlerini tanıma, inhibe etme ve/veya ortadan kaldırma gibi işlevler kazandırılır. Diğer yandan, TNF reseptörü ve insan antikorunun belirli bölümleriyle oluşturulan rekombinant füzyon proteini aracılığıyla da anti-TNF-alfa etkinlik sağlanabilir.1 2018 yılı itibariyle Amerika Birleşik Devletleri (ABD), Avrupa ülkeleri ve Türkiye’de çoğunlukla kronik otoimmün artritlerde ruhsatlı ve klinik kullanımda olan beş TNF-alfa inhibitörü vardır: Adalimumab, etanersept, golimumab, infliksimab ve sertolizumab.23-26
İnfliksimab, adalimumab ve golimumab insan TNF-alfaya karşı monoklonal antikor, sertolizumab insan TNF-alfaya karşı bir monoklonal antikor bileşeni ve etanersept de insan TNF reseptörlerinden elde edilmiş bir füzyon proteinidir.13 Çözünür TNF-alfaya bağlanmaları ve bunu nötralize etmeleri, TNF-alfa inhibitörlerinin en önemli ve ortak etki mekanizmasıdır.27
TNF-alfa İnhibitörlerinin Kullanıldığı Romatolojik Hastalıklar
Vücudun kendi dokularına bağışıklık yanıtı geliş-tirmesiyle karakterize olan otoimmün hastalıklarda vücut patojenik enflamatuvar moleküller ve otoantikorlar üreterek kendi proteinlerini hedefler ve bu süreç doku/organ hasarı ile sonuçlanır.20 Pro-enflamatuvar sitokinler otoimmün enflamasyon ve doku hasarına neden olurken, anti-enflamatuvar sitokinler enflamasyonun sonlanmasına yardımcı olur ve doku onarımını kolaylaştırır. Örneğin TNF-alfa, RA patogenezinde lökositlerin ekleme çağrılmasına yardımcı olarak kronik enflamasyonun sürdürülmesini sağlar, sinoviyal fibro-blastların proliferasyonunu indükleyerek pannus oluşumuna yol açar, artrit seyrinde anjiyogenez ve kıkırdak/kemik yıkımı süreçlerine katkıda bulunur; ayrıca ateş ve kaşeksi gibi sistemik etkilere de sahiptir.28
Enflamatuvar artritler, romatolojik hastalıklardaki başlıca kategorilerden birini oluşturur ve bunların da en yaygınları arasında RA, AS ve PsA gelir.29 TNF-alfa inhibitörleri bu hastalıkların yanı sıra ayrıca JİA tedavisinde de ruhsatlıdır.1
Romatoid artrit
En sık görülen kronik enflamatuvar artrit olan RA, persistan sinovit, sistemik enflamasyon ve otoantikor oluşumu ile karakterizedir.29,30 Daha çok kadınlar olmak üzere erişkinlerin %0,2-1,1’ini etkileyen RA’nın prevalansı özellikle 60 yaş üzerinde %2’lere kadar çıkmaktadır.31,32 Hastalığın patofizyolojisi temel olarak birkaç enflamatuvar kaskadın ortak bir yolak ile sonlanarak persistan sinoviyal enflamasyon ve ilişkili eklem kıkırdağı ve kemik hasarına neden olmasını kapsar. Sinovyumun enflamatuvar ortamındaki en önemli mekanizmalardan biri TNF-alfa aşırı üretimi ve ekspresyonuna neden olan yolaktır. Bu yolak, sinoviyal enflamasyon ve eklem destrüksiyonunun sürükleyici faktörüdür.30
RA’da aktif hastalığın kontrol altına alınmaması eklem hasarı, fonksiyonel kısıtlılık, yaşam kalitesinde azalma ile kardiyovasküler sorunlar ve enfeksiyonlar dahil diğer komorbid durumlar ile sonuçlanır. Bu klinik olayların merkezinde de enflamasyon olduğu için tedavide genel yaklaşım açısından bu sürecin geri çevrilmesi amaçlanır.30,33 Bu amaçlara yönelik farmakolojik müdahaleler ise genel olarak üç grup altında toplanır: Nonsteroidal antienflamatuvar ilaçlar (NSAİ), kortiko-steroidler ve hastalık seyrini değiştirici antiromatizmal ilaçlar (DMARD’lar). NSAİ’ler daha çok enflamasyon ve ağrı kontrolü sağlarken, diğer iki grup enflamasyondan sorumlu hücresel bağışıklık yanıtlarının bloke edilmesi amacıyla kullanılır.1,29 Özellikle DMARD’ların hastalığın erken dönemde verilmesinin klinik ve radyolojik sonuçları iyileştirdiği gösterilmiştir.34 Kortiko-steroidler ise geleneksel sentetik DMARD tedavisine başlanırken veya bunların arasında geçiş yapılırken kısa süreli olarak kullanılır.2
Avrupa Romatizma ile Savaş Derneği (EULAR) 2016 kılavuzu tarafından RA tanısı konduktan hemen sonra başlatılması önerilen grup olan DMARD’lar sen-tetik ve biyolojik olmak üzere iki kategoriye ayrılır.2 Metotreksat, hidroksiklorokin, leflunomid ve sülfasalazin gibi ilaçların yer aldığı ve ilk basamak tedavide kullanılan geleneksel sentetik DMARD’lar enflamatuvar artrit belirti ve bulgularını iyileştirse de sınırlı etkililiğe sahiptir.29 İlk basamak tedavi stratejisine yanıt alınamadığında tedaviye öncelikle TNF-alfa inhibitörleri olmak üzere biyolojik veya hedefli sentetik DMARD’lar eklenir. Eğer bu tedavilere de yanıt alınamazsa etki mekanizması farklı olan başka bir biyolojik veya hedefli sentetik DMARD tedavisine geçilir.2
Ankilozan spondilit
Spondiloartropatiler olarak adlandırılan bir romatolojik hastalık grubunun önemli bir alt tipi olan AS, aksiyal iskeleti etkileyerek tipik enflamatuvar sırt ağrısına ve bunun sonucunda da yapısal ve işlevsel kısıtlılığa ve yaşam kalitesinde bozulmaya yol açar. Daha çok erkekleri etkileyen hastalığın prevalansı %0,1-1,4 arasında değişmektedir. Hastalık daha çok erken yaşlarda ortaya çıkar; hastaların yaklaşık %80’inde ilk belirtiler 30 yaşından önce gelişir. Radyolojik olarak da gösterilen çift veya tek taraflı sakroileitin ve aksiyal iskeletin farklı bölgelerindeki enflamasyonun neden olduğu, 3 aydan fazla süren ve egzersizle iyileşen ancak istirahatle düzelmeyen bel ağrısı ve lomber omurganın ve göğüs ekspansiyonunun kısıtlılığı AS’deki tipik klinik özellikleri oluşturur. Buna periferik artrit, entezit ve ön üveit gibi enflamatuvar süreçler de eklenebilir. Osteoproliferasyon nedeniyle sindezmofitler ve ankiloz gibi karakteristik yapısal değişiklikler meydana gelir.35
Hastalığın patogenezi açısından en önemli genetik risk faktörü HLA-B27’dir.36 HLA-B27 molekülünün yanlış katlanması pro-enflamatuvar bir yanıta aracılık eder.29 Bununla birlikte, AS’de bugüne dek sorumlu olduğu ortaya konan 100’den fazla genetik odak, tüm genetik geçişin ancak %30’undan azını açıklamaktadır.36,37 Diğer yandan, TNF-alfanın da AS’li hastaların sakroiliyak eklem ve sinovyumunda artmış ekspresyonu gösterilmiştir.38 Aşırı TNF-alfa ekspresyonunun ayrıca spinal artrit ve yeni kemik oluşumuna yol açtığı bildirilmiştir.29,39
AS hastalığında tedavinin ana hedefi belirtilerin ve enflamasyonun kontrolü, ilerleyici yapısal hasarın önlenmesi, işlevsellik ve sosyal hayata katılımın korunması yoluyla sağlıkla ilişkili yaşam kalitesini azami hale getirmektir. Uluslararası Spondiloartrit Değerlendirmesi Derneği ve EULAR’ın ortak geliştirdiği 2016 kılavuzuna göre; ağrı ve tutukluğu olan hastalar ilk sıra tedavi olarak maksimum doza kadar NSAİ almalı ve iyi yanıt alınıyorsa hastalar semptomatik olduğu sürece bu tedavi devam ettirilmelidir. Bu tedaviler yetersizse muskuloskeletal enflamasyonun olduğu bölgeye kortikosteroid enjeksiyonu düşünülebilir.
Yalnızca aksiyal tutulumu olan hastalar geleneksel sentetik DMARD ile tedavi edilmemelidir; periferik artriti olan olgularda sülfasalazin kullanılabilir. Eğer hastalar toplam 4 hafta boyunca kullanılan en az iki NSAİ’ye rağmen ya da periferik tutulumu olduğu halde lokal kortikosteroid ve sistemik sülfasalazin tedavisine rağmen yüksek hastalık aktivitesine sahipse, tercihen TNF-alfa inhibitörü olmak üzere biyolojik DMARD tedavisi başlatılmalıdır. TNF-alfa inhibitörüne yanıt alınamazsa, başka bir TNF-alfa inhibitörü veya diğer biyolojik tedavilere geçilebilir.3
Psöriyatik artrit
Klinik açıdan spondiloartropatiler grubuna dâhil olan PsA, psöriazis hastalarının %7-30’u arasında değişen oranlarında görülen ve periferik eklemler, entezler, omurga ve gözleri etkileyen bir kronik sistemik enflamatuvar artrittir.40-43 Prevalansı 100 000 kişide 20 ila 420 olan PsA genellikle 40-50’li yaşlarda görülür; cinsiyet açısından ise belirgin bir baskınlık yoktur.44 Hastalıkta birden çok bölge ve eklem tutulumu görülebilir. Genellikle distal interfalengeal eklemlerde asimetrik tutulum gözlenmekle birlikte poliartiküler veya oligoartiküler paternler de izlenebilir. Hastalarda daktilit veya entezit gelişebilir. Radyolojik açıdan eklem aralığı mesafesinin korunduğu PsA’da eklem komşuluğunda yeni kemik oluşumu gözlenir.29,42
PsA’nın patofizyolojisinde de birçok otoimmün ve otoenflamatuvar hastalıkta olduğu gibi genetik ve çevresel faktörlerin karmaşık etkileşiminin kendiliğinden devam eden ve kalıcı bir bağışıklık yanıtı oluşturması yer alır.45 Daha önceden yapılan çalışmalarda özellikle PsA’lı hastaların sinovyumlarında TNF-alfa düzeylerinin yüksek olması ile birlikte patogenezde TNF-alfanın rol oynadığına işaret edilse de, buna son yıllarda IL-23 ve IL-17’nin de katıldığı ve hatta IL-23 ve I7’nin daha merkezi bir rol oynadığı kabul edilmektedir.43,46-48
PsA’nın birçok organ sistemini etkileyen heterojen yapısı tedaviyi zorlu kılsa da, ideal yaklaşım enflamatuvar artrit ve PsA ile ilişkili komorbid durumların uygun tedavisini içerir.49 PsA’lı hastalarda birincil tedavi hedefi belirtilerin kontrol altına alınması, yapısal hasarın önlenmesi ve işlevsellik ve sosyal yaşama katılımın normale dönmesi yoluyla sağlıkla ilişkili yaşam kalitesinin azami hale getirilmesidir. Bunun için de enflamasyonun ortadan kaldırılması çok önemlidir. Bu doğrultuda, PsA’lı hastalarda muskuloskeletal belirti ve bulguları gidermek üzere NSAİ’ler kullanılabilir. Periferik artriti olan hastalarda özellikle klinik belirti ve bulgular ve/veya eklem dışı hastalık klinik tablosu varsa erken dönemde geleneksel sentetik DMARD kullanılmalıdır.
Mevcut tedaviye yardımcı olarak lokal kortikosteroid enjeksiyon kullanımı göz önünde bulundurulmalıdır ancak sistemik kullanım yalnızca en düşük etkili dozda dikkatli olarak uygulanabilir. Periferik artriti olan ve en az bir geleneksel sentetik DMARD’a yeterli yanıt sağlanamayan hastalarda tedaviye genellikle bir TNF-alfa inhibitörü olmak üzere biyolojik DMARD ile devam edilmelidir. Bu hastalarda TNF-alfa inhibitörü uygun değilse diğer biyolojik ilaçlar veya hedefli sentetik ilaçlar kullanılabilir. Biyolojik bir DMARD’a ye-terli yanıtın oluşmadığı hastalarda başka bir biyolojik DMARD’a geçilmesi düşünülebilir.4
Jüvenil idiyopatik artrit
Daha önceden jüvenil RA ya da jüvenil kronik artrit olarak bilinen JİA, 16 yaştan önce başlayan ve nedeni bilinmeyen şekilde 6 haftadan fazla süren artrit ile karakterize heterojen hastalıklar grubunu kapsamaktadır.50 Sistemik artrit, oligoartrit, poliartrit, PsA, entezit ilişkili artrit ve farklılaşmamış artrit olmak üzere 6 grupta sınıflandırılan JİA’nın en sık görülen alt tipi oligoartrittir.51,52 Çocukluk çağındaki en sık kronik romatolojik hastalık olan JİA kız çocuklarında erkek çocuklarına göre daha fazla görülmektedir. Hastalığın prevalansı 100 000 kişide 20,5 olarak bildirilmiştir.50,53
JİA’da patogenez, sistemik artrit ve diğer JİA alt tipleri arasında farklılık göstermektedir.54,55 Kronik artritli çocuk hastaların serum ve sinovyumlarında artmış olduğu bildirilen TNF-alfa, sistemik olmayan diğer JİA alt tiplerinin patogenezinde ön plandadır, sistemik JİA’da ise daha geri planda gözükmektedir.56,57
JİA’da farmakolojik tedavinin amacı enflamasyonu erken dönemde agresif bir biçimde baskılamak ve komplikasyonları önlemektir; buna yönelik ajanlar arasında NSAİ’ler, lokal veya sistemik kortikosteroidler ve geleneksel ile biyolojik DMARD’lar yer alır.58,59 Amerikan Romatoloji Birliğinin JİA Tedavi Kılavuzunda tüm hastalık alt tiplerinin tedavisinde sırasıyla NSAİ, kortikosteroid, sentetik DMARD ve biyolojik DMARD’dan oluşan kademeli bir artırma yaklaşımı önerilir. Bu alt tipleri yansıtan eklem sayısına göre değişmekle birlikte bu kademeler arasındaki tedavi geçişi de hastalık aktivitesi ve tedaviye yanıt durumuna göre belirlenir.5 Sistemik JİA tedavisinde patogenezde rolü daha geride olan TNF-alfa inhibitörleri, diğer biyolojik tedavilere yanıt alınamayan durumlarda değerlendirilir.60 Öte yandan, diğer JİA alt tiplerinde sentetik DMARD’a yanıtsızlık halinde veya hastalık aktivitesi yüksekse uygun NSAİ kullanımı sonrasında doğrudan TNF-alfa inhibitörüne başlanabilir.5
TNF-alfa İnhibitörlerinin Advers Etkileri
DMARD’lar romatolojik hastalık seyrini, bağışıklık sistemini çeşitli yollarla düzenleyerek değiştiren ilaçlardır.61 Genel enfeksiyon ve lenfoma riskini artırdığı bilinen sentetik DMARD’ların aksine, aralarında TNF-alfa inhibitörlerinin de bulunduğu biyolojik DMARD’lar romatolojik hastalıkların tedavisine görece daha yeni girdiği için güvenlilik ile ilgili bilgileri daha kısıtlıdır.62,63 Ayrıca onay aldıkları randomize klinik çalışmalar daha kısa sürede, seçilmiş bir hasta popülasyonunda ve daha çok etkililik gözetilerek gerçekleştirildiği için buralardan edinilen advers etki verileri sınırlıdır.64
Bu grup içinde daha uzun süredir kullanılan TNF-alfa inhibitörü ilaçlarla ilgili yapılan birçok kayıt çalışması ve meta-analiz, bu ilaçların kullanımı sırasında bakteriyel, fungal ve fırsatçı ya da ciddi enfeksiyon riskinin hem normal popülasyondakine hem de geleneksel sentetik DMARD kullanımındakine göre artmış olduğunu göstermiştir.62,65-67 TNF-alfa inhibitörleri ile ilgili bu genel advers etki profilinin altında; normal bağışıklık yanıtında granülom oluşumu ve bunun sürdürülmesi, makrofaj aktivasyonu ve farklılaşması ve viral bağışıklık yanıtı gibi birçok rolü olan TNF-alfanın inhibe edilmesinin, intraselüler patojenlerden TB’ye, virüslerden diğer fırsatçı patojenlere dek birçok enfeksiyona zemin hazırlaması yatmaktadır.68-70 Başka bir ciddi advers etki olan lenfoma riski açısından ise, söz konusu riski genel popülasyona göre artırdığı ancak bu açıdan geleneksel DMARD’lar ile arasında bir fark olmadığı bildirilmiştir.71
TNF-alfa inhibitörleri ve tüberküloz
TB gelişimi, TNF-alfa inhibitörleri ile ilişkili enfeksiyonlar arasında klinik açıdan en fazla önemsenen durumdur. TB, genel olarak öksürük damlacığı yoluyla bulaşan ve M. tuberculosis kompleksinin neden olduğu bir enfeksiyon hastalığıdır. Olguların çoğunda (%85) akciğerde olmak üzere nekrotizan granülomatöz enfeksiyon ile karakterize olan hastalık, bunun dışında vücuttaki diğer tüm dokuları da tutabilir.72 Hastalığın klinik özellikleri tutulum bölgesi, M. tuberculosis basil popülasyonun boyutu, bağışıklık yanıtının gücü, hastanın yaşı ve eşlik eden hastalıkların olup olmamasına göre değişkenlik gösterir.73 M. tuberculosis’e maruz kalmak çoğu zaman semptomatik hastalığa neden olmaz.72
Her ne kadar dünya nüfusunun yaklaşık üçte biri bu patojen ile enfekte ise de, özellikle erişkin hastaların ancak %12 kadarında hastalık gelişir.74 Hastalığın oluşması enfekte olmuş kişinin bağışıklık durumuna bağlıdır; bağışıklığı baskılanmış kişilerde aktif hastalığa ilerleyiş daha olasıdır. Bağışıklığı normal olan kişilerde makrofaj ve T hücreleri tarafından oluşturulan granülom sayesinde M. tuberculosis’in kontrol altında tutulduğu latent enfeksiyon görülür. Bu mononükleer hücre topluluğunun sürdürülebilmesi için en önemli sitokinlerden biri TNF’tir. Bakterileri baskılanmış durumdan tekrar aktif hale getirebilen dış faktörlerin ya da granülomun parçalanmasına neden olan süreçlerin etkisiyle TB reaktivasyonu gelişebilir.72,75,76
TNF-alfa inhibitörü ilaçlar, TNF-alfanın granülomatöz enfeksiyonlarda enflamatuvar hücrelerin çağrılmasındaki, makrofaj etkilerini artırmadaki ve enflamatuvar yanıtların düzenlenmesindeki etkilerini bloke edip granülom yıkımına neden olabilirler.76 TNF-alfa inhibitörleri ile artmış TB riski ilk kez Wolfe ve ark. tarafından ABD’de 2004 yılında yayımlanan bir çalışma ile ortaya konmuştur.77 Daha sonra 2005 yılında İsveç’te yayımlanan başka bir kayıt çalışmasında TNF-alfa inhibitörü ile tedavi edilen RA hastalarında TB riskinin 4 kat arttığı bildirilmiştir.65 Bunun ardından TNF-alfa inhibitörü kullanımına dair TB risk artışı farklı ülkelerdeki birçok kayıt çalışmasıyla doğrulanmış,78-87 çeşitli meta-analizlerle de desteklenmiştir.66,88 Bu nedenle TNF-alfa inhibitörü alması planlanan hastalarda TB riskinin taranması ve riske ilişkin koruyucu önlemler alınmasına yönelik uzlaşı raporları veya kılavuzlar da yayımlanmıştır.7,89 Bunlara uyulması ile de belirli ülkelerde söz konusu riskte ciddi düşüşler elde edildiği bildirilmiştir.79,90
Türkiye’de de TNF-alfa inhibitörü kullanımına bağlı TB gelişmesi riskine yönelik koruyucu bazı önlemler alınmıştır. İlk olarak 2005 yılında Romatizma Araştırma ve Eğitim Derneği tarafından TNF-alfa inhibitörü başlatılacak hastalarda TB taraması önerilmiştir.91 Buna paralel olarak aynı yıl Sağlık Bakanlığı tarafından da bir genelge yayımlanarak bu ilaçların TB başta olmak üzere ciddi advers etkileri açısından izlemine dair mevzuat yürürlüğe girmiştir.92 Sağlık Bakanlığı’nın 2011 Tüberküloz Tanı ve Tedavi Kılavuzu’nda TNF-alfa inhibitörü kullanan ve tüberkülin deri testi pozitif (≥5mm) erişkinlere günde 5 mg/kg, çocuklara 10 mg/kg izoniyazid profilaksisinin 9 ay boyunca uygulanması önerilmiştir.93
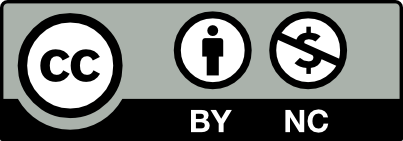
Güncel olarak ise Sağlık Bakanlığı Türkiye Halk Sağlığı Kurumu tarafından 2016 yılında Anti-TNF Tedavi Kullanan Hastalarda Tüberküloz Rehberi yayımlanmıştır. Buna göre; TNF-alfa inhibitörü tedavisi kararı alınan hastalarda TB hastalık araştırması yapılmalı ve TB saptanırsa uygun TB tedavisi verilmesi gerekmektedir. TB saptanmayan hastalarda latent TB enfeksiyonu taraması yapılmalı, latent enfeksiyon yoksa koruyucu tedavi vermeden TNF-alfa inhibitörü tedavisine başlanabilir. Latent enfeksiyon saptanan hastalarda ise koruyucu tedavi verilmelidir; koruma tedavisinin başlangıcından 1 ay sonra ise TNF-alfa inhibitörüne başlanabilir. Her koşulda, TNF-alfa inhibitörü başlanan tüm hastalarda 6 ayda bir TB hastalık taraması (çocuk hastalarda 3 ayda bir klinik, 6 ayda bir radyolojik kontrol olacak şekilde), yılda bir latent TB enfeksiyonu taraması yapılmalı ve pozitiflik saptanan durumlarda sırasıyla TB tedavisi ve koruyucu tedavi sonrasında TNF-alfa inhibitörü tedavisi uygulanmalıdır (Şekil 1.).94
Geçmişten bugüne dek süregelen bu TB risk yönetim stratejilerinin varlığına rağmen, ülkemizde yapılan bazı tek merkezli ve çok merkezli çalışmalarda TNF-alfa inhibitörü kullanımına bağlı TB sıklığının arttığı bildirilmiştir.95-100 Bunların arasında yüksek sayıda hastayla yapılan tek merkezli çalışmada TNF-alfa inhibitörü kullanan hastalarda TB insidansı %0,5 bulun-muştur.99 Çok merkezli yapılan çalışmada ise TNF-alfa inhibitörü kullanan 10,434 hasta incelenmiş ve TB insidansı %0,7 olarak bildirilmiştir.100 2013-2015 yılları arasında yapılan bir kohort çalışmasında ise bir yıllık TNF-alfa inhibitörü kullanımı sonucunda rölatif TB riskinin 4,7 kat arttığı bildirilmiştir.101
Tüberkülozun romatolojik hastalıklar ve bu hastalıkların diğer tedavileriyle ilişkisi
Özellikle RA hastalığı ile yapılan çalışmalar bu hastalıkta immünsupresif tedavilerin dışında hastalığın immünmodülatör etkileri nedeniyle de genel enfeksiyon insidansının arttığına işaret etmektedir.102 Ayrıca TB riski ile AS, RA, skleroderma gibi romatolojik hastalıklar da dahil olmak üzere belirli immün aracılı hastalıklar arasında ilişki olduğu da ortaya konmuştur.103 Yine RA hastaları ile yapılan çalışmalarda, bu hastalarda TB riskinin genel popülasyona kıyasla 2-10 kat arasında değişen oranlarda arttığı gösterilmiştir.65,90,104,105 Bu artmış riskin hastalığın yol açtığı immün bozukluklardan kaynaklandığı düşünülse de, bu çalışmalarda hastaların geleneksel DMARD ve/veya kortikosteroid öyküsüne sahip olması, romatolojik hastalıklar ile TB arasında tedaviden bağımsız bir risk artışı ilişkisinin ölçülmesini güçleştirmektedir.104,106
Latent TB enfeksiyonu olan hastaların %5-10’unda aktif TB hastalığı gelişme riski varken, bu riski en fazla artıran faktörlerden biri immünsupresif ilaç kullanımıdır.107,108 Romatolojik hastalıklarda kullanılan tedavilerden kortikosteroidlerin özellikle 1 aydan fazla süreyle orta ile yüksek dozda sistemik kullanımının TB riskini artırdığı bildirilmiştir.109 Bir RA kohort çalışmasında da TB gelişen hastalarda kortikosteroid kullanımının, TB gelişmeyenlere göre daha fazla olduğu saptanmıştır. Aynı çalışmada geleneksel sen-tetik DMARD’ların da TB riskini 1,2 kat artırdığı gösterilmiştir.78
Romatolojik hastalıkların tedavisine bağlı TB gelişme riski bütüncül bir yaklaşımla değerlendirilmelidir. Alternatif tedavi bileşenlerinin çoğu bu riski barındırmakta olup gerek basamaklı tedavi yaklaşımları, gerekse kombine tedavilerin hastalarda TB gelişme riskini artırabileceği göz önünde bulundurulmalıdır. Bu tedaviler ile halihazırda artmış riske biyolojik DMARD kullanımından doğan riskin eklenmesi sorunu daha da karmaşık hale getirmektedir. Kronik hastalıkların ras-yonel tedavi yönetimi çerçevesinde söz konusu riskin önlenmesi, saptanması, yönlendirilmesi ve tedavisi işlemlerinin her birinde birinci basamak hekimlerinin belirleyici rolleri vardır.
TNF-alfa inhibitörleri ve diğer enfeksiyonlar
TNF-alfa inhibitörü ilaçların granülom yapısının bütünlüğünü bozan etkileri nedeniyle TB dışındaki diğer granülomatöz enfeksiyonların da riskini artırması olasıdır.76 Bunlardan özellikle kandidiyazis, koksidiodomikoz, histoplazmozis, nokardiyozis, listeria ve non-tüberküloz mikobakteriyel enfeksiyon riskini artırdığı bildirilmiştir.6 Türkiye’de yapılan bir çalışmada ise kandida enfeksiyonlarının TNF-alfa inhibitörü kullananlarda, kullanmayan hastalara göre anlamlı olarak daha az, diğer granülomatöz enfeksiyon oranının ise bu iki grupta benzer olduğu bildirilmiştir.110 TNF-alfa inhibitörü kullanımıyla görülen kandidaya karşı koruyucu etkinin bu ilacı kullanmayan hastaların, diğer immünsupresif tedaviler nedeniyle kandida enfeksiyonlarına yatkın olmasından kaynaklanabileceği göz önünde bulundurulmalıdır.
TNF-alfa inhibitörleri ile herpes zoster enfeksiyonu ilişkisi de araştırılmıştır. Bu ilaçların kullanımına bağlı olarak genel popülasyona kıyasla yaklaşık 10 kat risk artışı gözlenmekle birlikte,111 geleneksel DMARD’lar ile yapılan karşılaştırmalarda riskin 1,4-1,5 kat arttığını veya benzer olduğunu bildiren çalışmalar nedeniyle net bir sonuca varılamamıştır.112-115 Ayrıca deri enfeksiyonları açısından da TNF-alfa inhibitörleri ve geleneksel DMARD’lar arasında bir fark olmadığı bildirilmiştir.116
Listeriozis, lejyonellozis ve fungal enfeksiyonlar gibi non-viral fırsatçı enfeksiyonlarda da yalnızca infliksimab ile birlikte geleneksel DMARD’lara kıyasla 2,6 katlık bir artış gösterilmiş, diğer TNF-alfa inhibitörleri ile böyle bir risk artışı bildirilmemiştir.83 Ciddi enfeksiyonlar açısından ise geleneksel DMARD’lara kıyasla TNF-alfa inhibitörü kullanımı ile birlikte 1,2-1,8 kat risk artışı olduğunu bildiren 2011 yılındaki iki çalışma mevcuttur.67,117 Finlandiya’da 2015 yılında yayımlanan başka bir kayıt çalışmasında ise bu iki grubun ciddi enfeksiyon açısından benzer olduğu bildirilmiştir.118
Literatüre TNF-alfa inhibitörü kullanımına bağlı enfeksiyonlar açısından yansıyan çalışmalarda, daha uzun süredir klinik kullanımda olmaları nedeniyle sıklıkla etanersept, infliksimab ve adalimumab araştırılmıştır. Her ne kadar zaman zaman birbirlerine göre enfeksiyon riskinde farklılıklar gözlense de, etki mekanizmaları ortak olduğu için bu ilaçları kullanan hastalarda etken maddeden bağımsız olarak potansiyel riskin farkında olunması olası tehlikelere karşı daha erken önlem alınmasını sağlayabilir. Nitekim TNF-alfa kullanımı öncesinde TB taramasını öneren uzlaşı raporunda da son yıllarda onay alan golimumab ve sertolizumab dâhil tüm ilaçlarda endikasyondan bağımsız olarak enfeksiyon riskine karşı koruyucu tedavi tavsiye edilmektedir.
Sonuç olarak, başta TB olmak üzere TNF-alfa inhibitörlerine dair artmış enfeksiyon riskinin farkında olunması riskin başarıyla yönetilmesinde kilit önem taşır. Mevcut ulusal kılavuz TB hastalık taramasının 6 ayda, latent enfeksiyon taramasının ise 12 ayda bir yapılmasını önermektedir. TB riskinin TNF-alfa inhibitörü kullanımı sonrası ilk 3 ayda daha belirgin olduğu göz önünde bulundurulduğunda, daha sık veya yakın takip, erken TB tanı ve tedavisini mümkün kılabilir. Bu ilaçları kullanan hastalar, genellikle başlangıç tedavisi için olmasa da, hastalıklarının kronik seyri, belirtileri ve olası komorbid durumlar nedeniyle birinci basamağa sıkça başvurmaktadır. Bu bakımdan TNF-alfa inhibitörleriyle tedavi edilmiş/edilmekte olan hastaların taşıdığı olası riskin farkındalığı, tespiti ve yönetilmesi konularında birinci basamak hekimlerinin aktif rol olması beklenir.
Referanslar
- Willrich MAV, Murray DL, Snyder MR. Tumor necrosis factor inhibitors: clinical utility in autoimmune diseases. Transl Res 2015;165(2):270-82.
- Smolen JS, Landewé R, Bijlsma J, Burmester G, Chatzidionysiou K, Dougados M, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann Rheum Dis 2017;76(6):960-77.
- van der Heijde D, Ramiro S, Landewé R, Baraliakos X, Van den Bosch F, Sepriano A, et al. 2016 update of the ASAS-EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017;76(6):978-91.
- Gossec L, Smolen JS, Ramiro S, de Wit M, Cutolo M, Dougados M, et al. European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies: 2015 update. Ann Rheum Dis 2016;75(3):499-510.
- Beukelman T, Patkar NM, Saag KG, Tolleson-Rinehart S, Cron RQ, DeWitt EM, et al. 2011 American College of Rheumatology recommendations for the treatment of juvenile idiopathic arthritis: Initiation and safety monitoring of therapeutic agents for the treatment of arthritis and systemic features. Arthritis Care Res (Hoboken) 2011;63(4):465-82.
- Wallis RS, Broder MS, Wong JY, Hanson ME, Beenhouwer DO. Granulomatous infectious diseases associated with tumor necrosis factor antagonists. Clin Infect Dis 2004;38(9):1261-5.
- Solovic I, Sester M, Gomez-Reino JJ, Rieder HL, Milburn HJ, et al. The risk of tuberculosis related to tumour necrosis factor antagonist therapies: a TBNET consensus statement. Eur Respir J 2010;36(5):1185-206.
- Ramiro S, Sepriano A, Chatzidionysiou K, Nam JL, Smolen JS, van der Heijde D, et al. Safety of synthetic and biological DMARDs: a systematic literature review informing the 2016 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis 2017;76:1093-101.
- Carswell EA, Old LJ, Kassel RL, Green S, Fiore N, Williamson B. An endotoxin-induced serum factor that causes necrosis of tumors. Proc Natl Acad Sci 1975;72(9):3666-70.
- Kelker HC, Oppenheim JD, Stone-Wolff D, Henriksen-DeStefano D, Aggarwal BB, Stevenson HC, et al. Characterization of human tumor necrosis factor produced by peripheral blood monocytes and its separation from lymphotoxin. Int J Cancer 1985;36(1):69-73.
- Aggarwal BB, Gupta SC, Kim JH. Historical perspectives on tumor necrosis factor and its superfamily: 25 years later, a golden journey. Blood 2012;119(3):651-65.
- Balkwill F. TNF-α in promotion and progression of cancer. Cancer Metastasis Rev 2006;25(3):409-16.
- Horiuchi T, Mitoma H, Harashima SI, Tsukamoto H, Shimoda T. Transmembrane TNF-α: Structure, function and interaction with anti-TNF agents. Rheumatology 2010;49:1215-28.
- Lazdins JK, Grell M, Walker MR, Woods-Cook K, Scheurich P, Pfizenmaier K. Membrane tumor necrosis factor (TNF) induced cooperative signaling of TNFR60 and TNFR80 favors induction of cell death rather than virus production in HIV-infected T cells. J Exp Med 1997;185(1):81-90.
- Birkland TP, Sypek JP, Wyler DJ. Soluble TNF and membrane TNF expressed on CD4+ T lymphocytes differ in their ability to activate macrophage antileishmanial defense. J Leukoc Biol 1992;51(April):296-9.
- Torres D, Janot L, Quesniaux VFJ, Grivennikov SI, Maillet I, Sedgwick JD, et al. Membrane tumor necrosis factor confers partial protection to Listeria infection. Am J Pathol 2005;167(6):1677-87.
- Flynn JL, Chan J. Immunology of tuberculosis. Annu Rev Immunol 2001;19(1);93-129.
- Saunders BM, Tran S, Ruuls S, Sedgwick JD, Briscoe H, Britton WJ. Transmembrane TNF is sufficient to initiate cell migration and granuloma formation and provide acute, but not long-term, control of mycobacterium tuberculosis infection. J Immunol 2005;174(8):4852-9.
- Mootoo A, Stylianou E, Arias MA, Reljic R. TNF-in tuberculosis: a cytokine with a split personality. Inflamm Allergy Drug Targets 2009;8:53-62.
- Vinay DS, Kwon BS. The tumour necrosis factor/TNF receptor superfamily: Therapeutic targets in autoimmune diseases. Clin Exp Immunol 2011;164(2):145-57.
- Pfeffer K. Biological functions of tumor necrosis factor cytokines and their receptors. Cytokine Growth Factor Rev 2003;14(3-4):185-91.
- Kollias G, Kontoyiannis D. Role of TNF/TNFR in autoimmunity: specific TNF receptor blockade may be advantageous to anti-TNF treatments. Cytokine Growth Factor Rev 2002;13(4-5):315-21.
- Kalliolias GD, Ivashkiv LB. TNF biology, pathogenic mechanisms and emer-ging therapeutic strategies. Nat Rev Rheumatol 2016;12(1):49-62.
- Rios Rodriguez V, Poddubnyy D. Tumor necrosis factor-α (TNFα) inhibitors in the treatment of nonradiographic axial spondyloarthritis: current evidence and place in therapy. Ther Adv Musculoskelet Dis 2017;9(8):197-210.
- U.S. Food & Drug Administration. FDA Drug Safety Communication: Drug labels for the Tumor Necrosis Factor-alpha (TNFα) blockers now include warnings about infection with Legionella and Listeria bacteria. Accessed from tarihinde erişilmiştir.https://www.fda.gov/Drugs/DrugSafety/ucm270849.htm adresinden 16/01/2018 tarihinde erişilmiştir.
- Türkiye İlaç ve Tıbbi Cihaz Kurumu. Kısa Ürün Bilgisi/Kullanma Talimatı Listesi. http://www.titck.gov.tr/KubKt/Index adresinden 16/01/2018 tarihinde erişilmiştir.
- Mitoma H, Horiuchi T, Tsukamoto H, Ueda N. Molecular mechanisms of action of anti-TNF-α agents – comparison among therapeutic TNF-α antagonists. Cytokine 2018;101:56-63.
- Kim EY, Moudgil KD. Immunomodulation of autoimmune arthritis by pro-inflammatory cytokines. Cytokine 2017;98:87-96.
- Thompson C, Davies R, Choy E. Anti cytokine therapy in chronic inflammatory arthritis. Cytokine 2016;86:92-9.
- Scott DL, Wolfe F, Huizinga TWJ. Rheumatoid arthritis. Lancet 2010;376(9746):1094-108.
- Alamanos Y, Voulgari PV, Drosos AA. Incidence and prevalence of rheumatoid arthritis, based on the 1987 American College of Rheumatology criteria: a systematic review. Semin Arthritis Rheum 2006;36(3):182-8.
- Rasch EK, Hirsch R, Paulose-Ram R, Hochberg MC. Prevalence of rheumatoid arthritis in persons 60 years of age and older in the United States: Effect of different methods of case classification. Arthritis Rheum 2003;48(4):917-26.
- Smolen JS, Aletaha D, McInnes IB. Rheumatoid arthritis. Lancet 2016;388(10055):2023-38.
- Nell VPK. Benefit of very early referral and very early therapy with disease-modifying anti-rheumatic drugs in patients with early rheumatoid arthritis. Rheumatology 2004;43(7):906-14.
- Braun J, Sieper J. Ankylosing spondylitis. Lancet 2007;369(9570):1379-90.
- Ranganathan V, Gracey E, Brown MA, Inman RD, Haroon N. Pathogenesis of ankylosing spondylitis – recent advances and future directions. Nat Rev Rheumatol 2017;13(6):359-67.
- Smith JA. Update on ankylosing spondylitis: current concepts in pathogenesis. Curr Allergy Asthma Rep 2015;15(1):489.
- Braun J, Bollow M, Neure L, Seipelt E, Seyrekbasan F, Herbst H, et al. Use of immunohistologic and in-situ hybridization techniques in the examination of sacroiliac joint biopsy specimens from patients with ankylosing spondylitis. Arthritis Rheum 1995;38(4):499-505.
- Jacques P, Lambrecht S, Verheugen E, Pauwels E, Kollias G, Armaka M, et al. Proof of concept: Enthesitis and new bone formation in spondyloarthritis are driven by mechanical strain and stromal cells. Ann Rheum Dis 2014;73(2):437-45.
- Prey S, Paul C, Bronsard V, Puzenat E, Gourraud PA, Aractingi S, et al. Assessment of risk of psoriatic arthritis in patients with plaque psoriasis: A systematic review of the literature. J Eur Acad Dermatology Venereol 2010;24(Suppl. 2):31-5.
- Mease PJ, Gladman DD, Papp KA, Khraishi MM, Thaçi D, Behrens F, et al. Prevalence of rheumatologist-diagnosed psoriatic arthritis in patients with psoriasis in European/North American dermatology clinics. J Am Acad Dermatol 2013;69(5):729-35.
- Huynh D, Kavanaugh A. Psoriatic arthritis: current therapy and future approaches. Rheumatology 2015;54(1):20-8.
- Sakkas LI, Bogdanos DP. Are psoriasis and psoriatic arthritis the same disease? The IL-23/IL-17 axis data. Autoimmun Rev 2017;16(1):10-5.
- Dhir V, Aggarwal A. Psoriatic arthritis: a critical review. Clin Rev Allergy Immunol 2013;44(2):141-8.
- Veale DJ. Psoriatic arthritis: Recent progress in pathophysiology and drug development. Arthritis Res Ther 2013;15(6):224.
- Kane D, FitzGerald O. Tumor necrosis factor-alpha in psoriasis and psoriatic arthritis: a clinical, genetic, and histopathologic perspective. Curr Rheumatol Rep 2004;6:292-8.
- van Kuijk AWR, Reinders-Blankert P, Smeets TJM, Dijkmans BAC, Tak PP. Detailed analysis of the cell infiltrate and the expression of mediators of synovial inflammation and joint destruction in the synovium of patients with psoriatic arthritis: Implications for treatment. Ann Rheum Dis 2006;65(12):1551-7.
- Barnas JL, Ritchlin CT. Etiology and pathogenesis of psoriatic arthritis. Rheum Dis Clin North Am 2015;41(4):643-63.
- Raychaudhuri SP, Wilken R, Sukhov AC, Raychaudhuri SK, Maverakis E. Management of psoriatic arthritis: early diagnosis, monitoring of disease severity and cutting edge therapies. J Autoimmun 2017;76:21-37.
- Prakken B, Albani S, Martini A. Juvenile idiopathic arthritis. Lancet 2011;377(9783):2138-49.
- Eisenstein EM, Berkun Y. Diagnosis and classification of juvenile idiopathic arthritis. J Autoimmun 2014;48-49:31-3.
- Ravelli A, Martini A. Juvenile idiopathic arthritis. Lancet 2007;369(9563):767-78.
- Thierry S, Fautrel B, Lemelle I. Prevalence and incidence of juvenile idiopathic arthritis: A systematic review. Joint Bone Spine 2014;81(2):112-7.
- Steigerwald KA, Ilowite NT. Novel treatment options for juvenile idiopathic arthritis. Expert Rev Clin Pharmacol 2015;8(5):559-73.
- Ombrello MJ, Arthur VL, Remmers EF, Hinks A, Tachmazidou I, Grom AA, et al. Genetic architecture distinguishes systemic juvenile idiopathic arthritis from other forms of juvenile idiopathic arthritis: Clinical and therapeutic implications. Ann Rheum Dis 2017;76(5):906-13.
- Kutukculer N, Caglayan S, Aydogdu F. Clinical rheumatology juvenile chronic arthritis: correlations with clinical and laboratory parameters. Clin Rheumatol 1998;288-92.
- Russo R, Katsicas MM. Clinical remission in patients with systemic juvenile idiopathic arthritis treated with anti-tumor necrosis factor agents. J Rheumatol 2009;36(5):1078-82.
- Armon K. Outcomes for juvenile idiopathic arthritis. Paediatr Child Heal (United Kingdom) 2014;24(2):64-71.
- Giancane G, Consolaro A, Lanni S, Davì S, Schiappapiet B, Ravelli A. Juvenile idiopathic arthritis: diagnosis and treatment. Rheumatol Ther 2016;3(2):187-207.
- Ringold S, Weiss PF, Beukelman T, DeWitt EM, Ilowite NT, Kimura Y, et al. 2013 Update of the 2011 American College of Rheumatology Recommendations for the treatment of juvenile idiopathic arthritis: Recommendations for the medical therapy of children with systemic juvenile idiopathic arthritis and tuberculosis screening among children receiving biologic medications. Arthritis Rheum 2013;65(10):2499-512.
- Chandrashekara S. Pharmacokinetic consideration of synthetic DMARDs in rheumatoid arthritis. Expert Opin Drug Metab Toxicol 2013;9(8):969-81.
- Greenberg JD, Reed G, Kremer JM, Tindall E, Kavanaugh A, Zheng C, et al. Association of methotrexate and tumour necrosis factor antagonists with risk of infectious outcomes including opportunistic infections in the CORRONA registry. Ann Rheum Dis 2010;69(2):380-6.
- Mercer LK, Davies R, Galloway JB, Low A, Lunt M, Dixon WG, et al. Risk of cancer in patients receiving non-biologic disease-modifying therapy for rheumatoid arthritis compared with the UK general population. Rheumatology 2013;52(1):91-8.
- Ruderman EM. Overview of safety of non-biologic and biologic DMARDs. Rheumatology (Oxford) 2012;51(Suppl. 6):37-43.
- Askling J, Baecklund E, Granath F, Geborek P, Fored M, Backlin C, et al. Anti-tumour necrosis factor therapy in rheumatoid arthritis and risk of malignant lymphomas: Relative risks and time trends in the Swedish Biologics Register. Ann Rheum Dis 2009;68(5):648-53.
- Zhang Z, Fan W, Yang G, Xu Z, Wang J, Cheng Q, et al. Risk of tuberculosis in patients treated with TNF-α antagonists: A systematic review and meta-analysis of randomised controlled trials. BMJ Open 2017;7(3):e012567.
- Galloway JB, Hyrich KL, Mercer LK, Dixon WG, Fu B, Ustianowski AP, et al. Anti-TNF therapy is associated with an increased risk of serious infections in patients with rheumatoid arthritis especially in the first 6 months of treatment: updated results from the British Society for Rheumatology Biologics Register with special emphasis on risks in the elderly. Rheumatology (Oxford) 2011;50(1):124-31.
- Roach DR, Bean AGD, Demangel C, France MP, Briscoe H, Britton WJ. TNF regulates chemokine induction essential for cell recruitment, granuloma formation, and clearance of mycobacterial infection. J Immunol 2002;168(9):4620-7.
- Carroll MB, Forgione MA. Use of tumor necrosis factor α inhibitors in hepatitis B surface antigen-positive patients: A literature review and potential mechanisms of action. Clin Rheumatol 2010;29(9):1021-9.
- Ali T, Kaitha S, Mahmood S, Ftesi A, Bronze MS. Clinical use of anti-TNF therapy and increased risk of infections. Drug Healthc Patient Saf 2013; 5:79-99.
- Askling J, Fored CM, Brandt L, Baecklund E, Bertilsson L, Cöster L, et al. Risk and case characteristics of tuberculosis in rheumatoid arthritis associated with tumor necrosis factor antagonists in Sweden. Arthritis Rheum 2005;52(7):1986-92.
- Dheda K, Barry CE, Maartens G. Tuberculosis. Lancet 2016;387(10024):1211-26.
- Hopewell PC. Clinical features of tuberculosis. In: Handbook of Tuberculosis: Clinics, Diagnostics, Therapy and Epidemiology. (eds) Kaufman and van Helden. 1st ed. Weinheim, Wiley, 2008:89-113.
- Vynnycky E, Fine PEM. The natural history of tuberculosis: The implications of age-dependent risks of disease and the role of reinfection. Epidemiol Infect 1997;119(2):183-201.
- Fogel N. Tuberculosis: A disease without boundaries. Tuberculosis (Edinb) 2015;95(5):527-31.
- Ehlers S. Tumor necrosis factor and its blockade in granulomatous infections: differential modes of action of infliximab and etanercept? Clin Infect Dis 2005; 41(Suppl 3):199-203.
- Wolfe F, Michaud K, Anderson J, Urbansky K. Tuberculosis infection in patients with rheumatoid arthritis and the effect of infliximab therapy. Arthritis Rheum 2004;50(2):372-9.
- Brassard P, Kezouh A, Suissa S. Antirheumatic drugs and the risk of tuberculosis. Clin Infect Dis 2006;43(6):717-22.
- Gómez-Reino JJ, Carmona L, Ángel Descalzo M. Risk of tuberculosis in patients treated with tumor necrosis factor antagonists due to incomplete prevention of reactivation of latent infection. Arthritis Rheum 2007;57(5):756-61.
- Tubach F, Salmon D, Ravaud P, Allanore Y, Goupille P, Bréban M, et al. Risk of tuberculosis is higher with anti-tumor necrosis factor monoclonal antibody therapy than with soluble tumor necrosis factor receptor therapy: the three-year prospective French research axed on tolerance of biotherapies registry. Arthritis Rheum 2009;60(7):1884-94.
- Winthrop KL, Chang E, Yamashita S, Iademarco MF, LoBue PA. Nontuberculous mycobacteria infections and anti-tumor necrosis factor-α therapy. Emerg Infect Dis 2009;15(10):1556-61.
- Ke WM, Chen LS, Parng IM, Chen WW, On AWF. Risk of tuberculosis in rheumatoid arthritis patients on tumour necrosis factor-alpha inhibitor treatment in Taiwan. Int J Tuberc Lung Dis 2013;17(12):1590-5.
- Baddley JW, Winthrop KL, Chen L, Liu L, Grijalva CG, Delzell E, et al. Non-viral opportunistic infections in new users of tumour necrosis factor inhibitor therapy: Results of the SAfety assessment of biologic ThERapy (SABER) study. Ann Rheum Dis 2014;73(11):1942-8.
- Chung KB, Lee EY, Im JP, Han SK, Yim JJ. Clinical characteristics and treatment responses of patients who developed tuberculosis following use of a tumor necrosis factor-α inhibitor. Korean J Intern Med 2013;28(2):174.
- Navarra S V, Tang B, Lin H-Y, Chiu MOK C, Asavatanabodee P, Suwannalai P, et al. Risk of tuberculosis with anti-tumor necrosis factor-a therapy: substantially higher number of patients at risk in Asia. Int J Rheum Dis 2014; 17:291-8.
- Chan MJ, Wen YH, Huang YB, Chuang HY, Tain YL, Lily Wang YC, et al. Risk of tuberculosis comparison in new users of antitumour necrosis factor-α and with existing disease-modifying antirheumatic drug therapy. J Clin Pharm Ther 2017; doi: 10.1111/jcpt.12644. [Epub ahead of print].
- Lee EH, Kang YA, Leem AY, Park MS, Kim YS, Kim SK, et al. Active tuberculosis incidence and characteristics in patients treated with tumor necrosis factor antagonists according to latent tuberculosis infection. Sci Rep 2017;7(1):6473.
- Minozzi S, Bonovas S, Lytras T, Pecoraro V, González-Lorenzo M, Bastiampillai AJ, et al. Risk of infections using anti-TNF agents in rheumatoid arthritis, psoriatic arthritis, and ankylosing spondylitis: a systematic review and meta-analysis. Expert Opin Drug Saf 2016;15(sup1):11-34.
- Nordgaard-Lassen I, Dahlerup JF, Belard E, Gerstoft J, Kjeldsen J, Kragballe K, et al. Guidelines for screening, prophylaxis and critical information prior to initiating anti-TNF-alpha treatment. Dan Med J 2012;59(7):1-12.
- Arkema EV, Jonsson J, Baecklund E, Bruchfeld J, Feltelius N, Askling J, ARTIS Study Group. Are patients with rheumatoid arthritis still at an increased risk of tuberculosis and what is the role of biological treatments? Ann Rheum Dis 2015;74(6):1212-7.
- Kalfa M, Aksu K. Anti-tümör nekrozis faktör-α tedavisi ve enfeksiyon. RAED Dergisi 2011;3: 49-56.
- T.C. Sağlık Bakanlığı İlaç ve Eczacılık Genel Müdürlüğü. 149/2005 Sayılı Genelge; 2005.
- T.C. Sağlık Bakanlığı. Tüberküloz Tanı ve Tedavi Rehberi. Ankara, Sağlık Bakanlığı Yayını No: 862, 2011, ISBN: 978-975-590-411-5.
- T.C. Sağlık Bakanlığı, Türkiye Halk Sağlığı Kurumu. Anti-TNF Kullanan Hastalarda Tüberküloz Rehberi. Ankara, Sağlık Bakanlığı Yayını, 2016.
- Hanta I, Ozbek S, Kuleci S, Kocabas A. The evaluation of latent tuberculosis in rheumatologic diseases for anti-TNF therapy: Experience with 192 patients. Clin Rheumatol 2008;27(9):1083-6.
- Elbek O, Uyar M, Aydin N, Börekçi S, Bayram N, Bayram H, et al. Increased risk of tuberculosis in patients treated with antitumor necrosis factor alpha. Clin Rheumatol 2009;28(4):421-6.
- Cagatay T, Aydin M, Sunmez S, Cagatay P, Gulbaran Z, Gul A, et al. Follow-up results of 702 patients receiving tumor necrosis factor-α antagonists and evaluation of risk of tuberculosis. Rheumatol Int 2010 Sep;30(11):1459-63.
- Dogan C, Kiral N, Comert SS, Fidan A, Caglayan B, Salepci B. Tuberculosis frequency in patients taking TNF-alpha blockers. Turk Toraks Derg 2012;13(3):93-8.
- Borekci S, Atahan E, Demir Yilmaz D, Mazican N, Duman B, Ozguler Y, et al. Factors affecting the tuberculosis risk in patients receiving anti-tumor necrosis factor-a treatment. Respiration 2015;90(3):191-8.
- Kisacik B, Pamuk ON, Onat AM, Erer SB, Hatemi G, Ozguler Y, et al. Characteristics predicting tuberculosis risk under tumor necrosis factor-α inhibitors: Report from a large multicenter cohort with high background prevalence. J Rheumatol 2016;43(3):524-9.
- Akici A, Aydin V, Kadi E, Isli F, Gursoz H. Increased risk of tuberculosis in patients with rheumatologic diseases managed with anti-TNF-α agents: a nationwide retrospective pharmacoepidemiological cohort study in Turkey. Clin Ther 2017; 39(8):e57.
- Doran MF, Crowson CS, Pond GR, O’Fallon WM, Gabriel SE. Frequency of infection in patients with rheumatoid arthritis compared with controls: A population-based study. Arthritis Rheum 2002;46(9):2287-93.
- Ramagopalan SV, Goldacre R, Skingsley A, Conlon C, Goldacre MJ. Associations between selected immune-mediated diseases and tuberculosis: Record-linkage studies. BMC Med 2013; 11:97.
- Carmona L, Hernandez-Garcia C, Vadillo C, Pato E, Balsa A, González-Alvaro I, et al. Increased risk of tuberculosis in patients with rheumatoid arthritis. J Rheumatol 2003; 30:1436-9.
- Brassard P, Lowe AM, Bernatsky S, Kezouh A, Suissa S. Rheumatoid arthritis, its treatments, and the risk of tuberculosis in Quebec, Canada. Arthritis Care Res 2009;61(3):300-4.
- Bouza E, Moya JG, Munoz P. Infections in systemic lupus erythematosus and rheumatoid arthritis. Infect Dis Clin North Am 2001;15(2):335-61, vii.
- Cruz-Knight W, Blake-Gumbs L. Tuberculosis: An overview. Prim Care 2013;40(3):743-56.
- Salgame P, Geadas C, Collins L, Jones-López E, Ellner JJ. Latent tuberculosis infection – Revisiting and revising concepts. Tuberculosis 2015;95(4):373-84.
- Kim HA, Yoo CD, Baek HJ, Lee EB, Ahn C, Han JS, et al. Mycobacterium tuberculosis infection in a corticosteroid-treated rheumatic disease patient population. Clin Exp Rheumatol 1998;16(1):9-13.
- Aydin V, Isli F, Aydin M, Akici A. The risk of granulomatous/candidal ınfections in patients managed with anti-TNF-alpha agents due to rheumatologic conditions in Turkey. International Meeting on Education & Research in Health Sciences, 3-5th November 2017, Istanbul, Turkey, P60.
- García-Doval I, Pérez-Zafrilla B, Descalzo MA, Roselló R, Hernández MV, Gómez-Reino JJ, et al. Incidence and risk of hospitalisation due to shingles and chickenpox in patients with rheumatic diseases treated with TNF antagonists. Ann Rheum Dis 2010; 69:1751-5.
- Galloway JB, Mercer LK, Moseley A, Dixon WG, Ustianowski AP, Helbert M, et al. Risk of skin and soft tissue infections (including shingles) in patients exposed to anti-tumour necrosis factor therapy: results from the British Society for Rheumatology Biologics Register. Ann Rheum Dis 2013; 72:229-34.
- McDonald JR, Zeringue AL, Caplan L, Ranganathan P, Xian H, Burroughs TE, et al. Herpes zoster risk factors in a national cohort of veterans with rheumatoid arthritis. Clin Infect Dis 2009; 48:1364–71.
- Winthrop KL, Baxter R, Liu L, Varley CD, Curtis JR, Baddley JW, et al. Mycobacterial diseases and antitumour necrosis factor therapy in USA. Ann Rheum Dis 2013;72(1):37-42.
- Pappas DA, Hooper MM, Kremer JM, Reed G, Shan Y, Wenkert D, et al. Herpes zoster reactivation in patients with rheumatoid arthritis: analysis of disease characteristics and disease-modifying antirheumatic drugs. Arthritis Care Res (Hoboken) 2015; 67:167-8.
- Wasson NJ, Varley CD, Schwab P, Fu R, Winthrop KL. “Serious skin & soft tissue infections in rheumatoid arthritis patients taking anti-tumor necrosis factor alpha drugs: a nested case-control study”. BMC Infect Dis 2013; 13:533.
- Strangfeld A, Eveslage M, Schneider M, Bergerhausen HJ, Klopsch T, Zink A, et al. Treatment benefit or survival of the fittest: what drives the time-dependent decrease in serious infection rates under TNF inhibition and what does this imply for the individual patient? Ann Rheum Dis 2011; 70:1914-20.
- Aaltonen KJ, Joensuu JT, Virkki L, Sokka T, Aronen P, Relas H, et al. Rates of serious infections and malignancies among patients with rheumatoid arthritis receiving either tumor necrosis factor inhibitor or rituximab therapy. J Rheumatol 2015;42(3):372-8.